
系
客
服

扫码留言


摘要:本研究探讨了iRoot快速凝固根管修复材料(iRoot Fast Set root repair material,iRoot FS)对人牙髓干细胞增殖、迁移和分化的影响。分别使用浓度为0.2和2mg/mL(分别称为FS0.2和FS2)的iRoot FS处理人牙髓干细胞(human dental pulp stem Cells,hDPSCs),并以相应浓度的生物牙本质(Biodentine,BD;Septodont公司,法国)处理组作为阳性对照组。通过CCK8试验检测细胞的增殖情况。利用创伤愈合和transwell试验进行细胞迁移的检测。通过碱性磷酸酶活性的检测、茜素红染色以及实时定量逆转录酶聚合酶链反应(quantitative realtimereverse-transcriptase polymerase chain reaction,qRT-PCR)分析分化相关基因mRNA的表达以检测hDPSCs的成骨向分化水平。结果表明,在第3天和第7天,FS组和BD组细胞增殖率高于空白对照组。此外,FS0.2组细胞迁移增多,且hDPSCs的成骨向分化明显增强。这些研究结果表明iRoot FS是一种能够促进细胞增殖、迁移和成骨分化的生物活性材料。
前言
牙髓暴露通常由龋齿和外伤引起。直接盖髓(direct pulp capping,DPC)是牙髓暴露的很好治疗方案,将药剂或材料放置在暴露牙髓上以保持牙髓活力并诱导修复性牙本质形成1。盖髓材料是影响牙髓成活的重要因素2。理想的盖髓剂应易于使用,对牙本质具有良好的密封性,对牙髓无刺激或刺激非常轻微,并可以促进细胞粘附、迁移和修复性牙本质的形成。
由于氢氧化钙缺乏固有的粘合性,密封性差,且随时间推移易溶解,三氧化矿物凝聚体(mineral trioxide aggregate,MTA)逐渐被用作盖髓剂3-8。然而,由于凝固时间长,易导致牙齿和牙龈组织变色,且组分内存在有毒元素,以及不易处理和去除这种化合物,MTA显示了其作为盖髓材料的缺陷9-11。因此,仍然难以找到理想的盖髓剂。Biodentine是一种新型的牙本质替代材料,在凝固时间、处理难度、性能和生物相容性等方面都较MTA有优势12,目前已被很好地研究并广泛应用于临床13-15。因此,本研究选用其作为阳性对照。
iRoot 材料(Innovative BioCeramix 公司,加拿大),包括iRoot SP、iRoot BP和iRoot BP Plus,均是硅酸钙基生物陶瓷材料,具有不收缩、不可溶、不含铝和良好的生物相容性等特性的牙本质替代品16-19。iRoot FS是一种对iRoot Putty Plus改良的材料, 具有良好的生物相容性、无致突变性、无过敏性、皮下耐受性好等特性。最近研究表明,iRoot FS较MTA、ERRM Putty(Brasseler公司,美国)、IRM(Dentsply Caulk,美国)具有更快的凝固时间(1小时以内)和水化过程。iRoot FS也拥有与MTA相似的根尖封闭能力20,21。尽管有大量文献报导iRoot FS的优势,但只有两篇文献报导了iRoot FS的生物学性能22,23。Jiang等人22使用成骨样细胞(MG63)和小鼠结缔组织成纤维细胞(L929)比较了iRoot BP Plus、iRoot FS、ProRoot MTA和Super-EBA的细胞相容性。在这些材料中,iRoot FS显示出很好的促进细胞粘附的性能。Qiao等人发现iRoot可以很好地促进MG63细胞的体外分化和矿化。受损的牙髓牙本质复合体的再生依赖于盖髓材料对人牙髓干细胞(hDPSCs)的迁移、增殖和分化的影响24。然而,目前尚未见iRoot FS作为盖髓剂引起牙髓细胞反应的相关报导。因此,本研究的目的是评估iRoot-FS对人牙髓干细胞增殖、迁移和分化的影响。
精选导读
材料准备
分别制备0.2和2mg/mL 两种浓度的Biodentine和iRoot FS的洗脱液,分别称为BD0.2、BD2、FS0.2和FS2。简单地说,按照制造商的说明,在无菌条件下,将BD和FS预混成糊状,随后在37°C下放置24小时。将固化膏体研磨成粉末,随后溶于DMEM培养基(HyClone,赛默飞世尔科技公司,美国)中,浓度为20mg/mL。之后,在37°C和100%湿度下涡旋培养3天,过滤,并稀释至适当的最终浓度,作为补充10%胎牛血清的完整培养基使用25。
细胞培养
本研究获得四川大学华西口腔医院机构评审委员会批准(WCHSIRB-D-2015-087)。hDPSCs的获取和培养如前所述26。在征得患者知情同意后,收集青少年(12-14岁)因正畸原因拔除的前磨牙。分离牙髓,切成小块(1×1×1mm),使用1mg/ml I型胶原酶(Gibco,赛默飞世尔科技公司)在37°C的振荡浴中消化60分钟,离心经消化后的牙髓组织,并将其转移到含有10%的胎牛血清(FBS,Gibco)和1%青霉素链霉素(Sigma-Aldrich 公司,美国)的DMEM培养基的培养瓶内,在37°C和5% CO₂培养箱中孵育10天,然后观察hDPSCs细胞集落。培养基每3天更换一次。本研究采用第6代hDPSCs进行实验。
流式细胞分析
收集hDPSCs,置于冷的Dulbecco磷酸盐缓冲盐水(Dulbecco’s phosphate-buffered saline,DPBS,赛默飞世尔科技公司)中,随后用FITC 偶联的抗人CD29、CD44、CD105、CD31、CD34、CD45抗体(BD生物科学, 美国),4°C避光孵育30分钟。采用流式细胞仪(Beckman Coulter公司,FC500,美国)分析样本,利用FlowJo流式细胞分析软件(Tree Star公司,美国)分析数据。
细胞增殖试验
本研究采用FS0.2和FS2组作为观察iRoot FS对hDPSC增殖影响的处理组。单纯培养基培养的细胞为空白对照组,BD0.2和BD2为阳性对照组。将细胞以1×10⁴/cm²的密度接种在48孔组织培养聚苯乙烯(tissue culture polystyrene,TCPS)板上(Corning 公司,美国),隔天更换培养基。用CCK-8细胞增殖试剂盒(Dojindo公司,日本)检测hDPSCs的增殖情况。简言之,在细胞接种后的第1、3和7天,用CCK-8试剂培养细胞一个小时。随后,将溶液转移到96孔板中,并在450nm处测定吸光度值。
迁移试验
对于创伤愈合试验来说,将hDPSCs接种到6孔TCPS板上,细胞融合后,无血清饥饿24小时,用10μL微量吸管尖做一个划痕。用DPBS 清洗掉细胞碎屑,然后用含1% FBS的BD0.2、BD2、FS0.2和FS2处理24小时。分别在0和24小时,用相差显微镜观察样本,随机拍摄四张照片进行细胞计数分析。
使用双室Transwell系统(Corning公司)进行细胞迁移分析27。简而言之,以5×10⁵/ml的浓度将hDPSCs悬浮在无血清培养基中。随后,将100μL细胞悬浮液加入到上室,700μL无血清的BD0.2、BD2、FS0.2或FS2培养基加入下室。24小时后,用0.1%结晶紫对膜下方的细胞染色20分钟。为了便于计数,样品进一步用4',6-二胺基-2'-苯吲哚盐酸盐(DAPI)染色,然后在荧光显微镜下随机选取4个视野进行分析。
碱性磷酸酶(ALP)染色及活性分析
将hDPSCs以5×10³/cm³的密度接种在24孔TCPS板上,在完全培养基里培养24小时。空白对照细胞随后用含100nM地塞米松、10mM β-甘油磷酸以及0.28 mM抗坏血酸(Sigma-Aldrich公司)的成骨诱导液培养。BD(阳性对照)组或FS组细胞在成骨诱导液中加入不同浓度的材料稀释液(终浓度分别为0.2和2mg/mL)。在第7天和第14天,进行ALP染色和活性测定以检测其成骨向分化的程度28,29。使用白细胞碱性磷酸酶试剂盒(Sigma-Aldrich公司)进行ALP染色,ALP阳性细胞会被染成蓝色。根据碱性磷酸酶定量试剂盒(建城生物工程研究所,中国)的产品说明书进行ALP活性分析。
茜素红染色及定量分析
用茜素红(Alizarin Red S,ARS)染色(Sigma-Aldrich公司)测定hDPSC 的矿化。在成骨培养基培养21天后,用4%多聚甲醛固定细胞,然后室温下用2%(w/v)茜素红孵育5分钟。用DPBS清洗五次后在显微镜下观察。随后,在室温下用10%(w/v)氯化十六烷基吡啶脱色15分钟,在562nm处测量吸光度29。
RNA提取及实时定量逆转录酶聚合酶链反应(qRT-PCR)
将hDPSCs以5×10³/cm²的密度接种在6孔TCPS平板上,在含或不含BD(BD0.2和BD2)和FS(FS0.2和FS2) 的成骨诱导液中培养14天。使用SYBR Green qRT PCR 试剂盒(Takara公司,日本)检测第1、7、14天细胞I型胶原(COL1)基因和骨钙素(OCN)基因的表达。
以下引物序列被用于qRT-PCR:
COL1,5’-CCCGGGTTTCAGAGACAACTTC-3’(正向)5’-TCCACATGCTTTATTCCAGCAATC-3’(反向);
OCN,5’-CCCAGGCGCTACCTGTATCAA-3’(正向)5’-GGTCAGCCAACTCGTCACAGTC-3'(反向)。
统计学分析
采用单因素方差分析(ANOVA)法对数据进行分析,然后进行Student-Newman-Keuls 检验,P≤0.05被认为具有统计学差异。
结果
hDPSCs的免疫表型分析
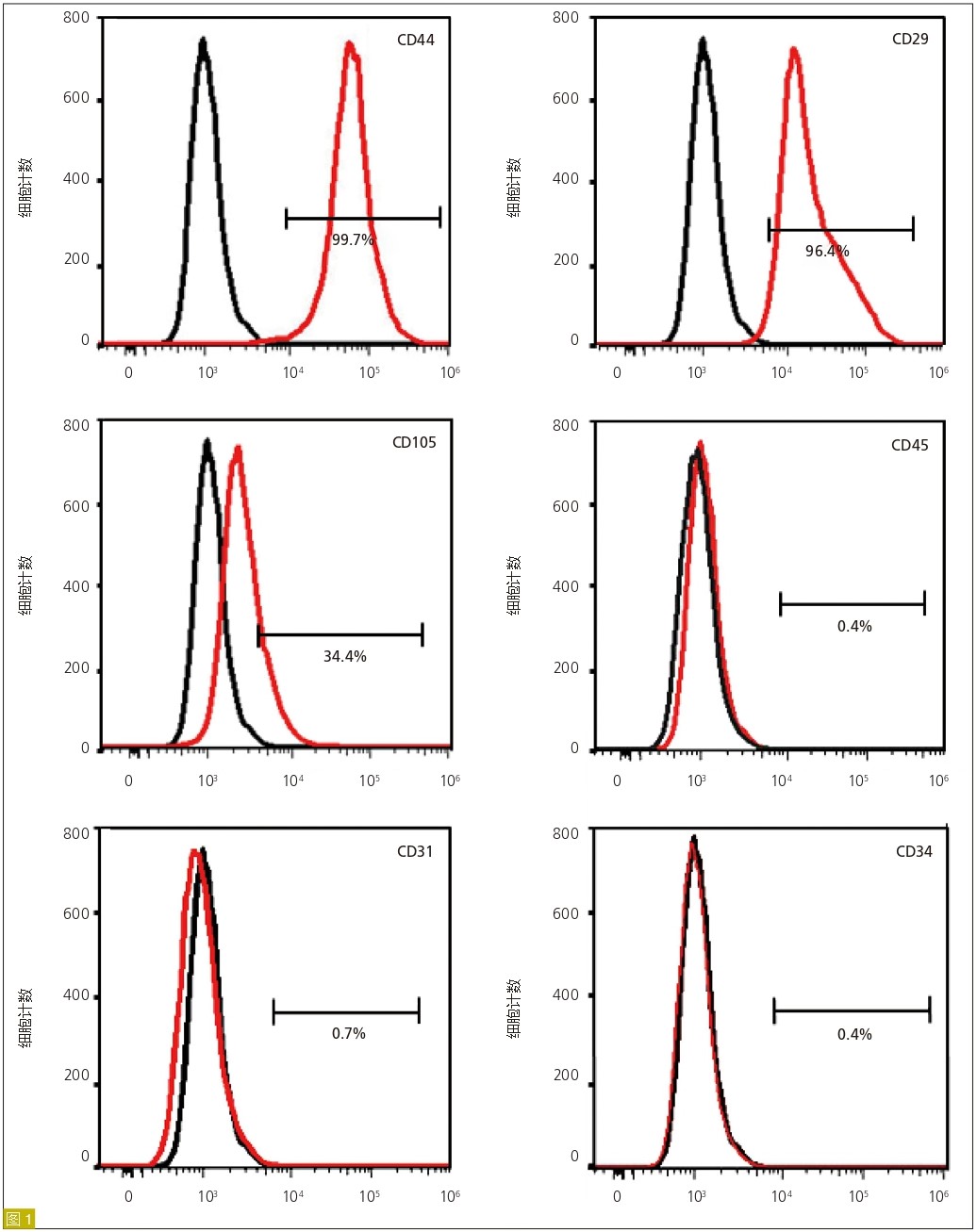
图1:hDPSCs的免疫表型。流式细胞术结果表明hDPSCs高表达MSC表面标志物,且不表达造血细胞和内皮细胞的典型标记物。用表面标记物染色的hDPSCs用红色曲线显示,未染色的对照组为黑色曲线。
细胞增殖
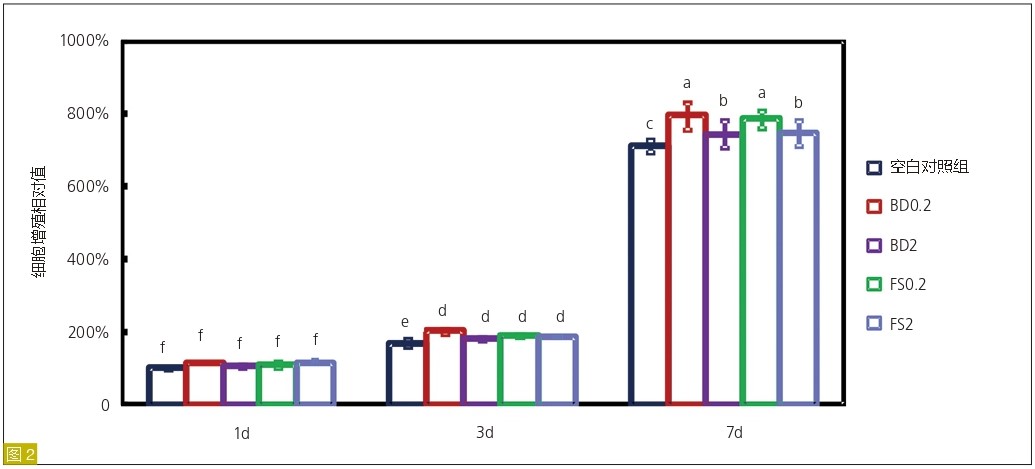
图2:BD0.2、BD2、FS0.2和FS2组hDPSCs的增殖情况。第1、3、7天进行CCK8测定(平均值±标准差;n=4)。不同字母代表的值之间差异显著(P<0.05)。
细胞迁移
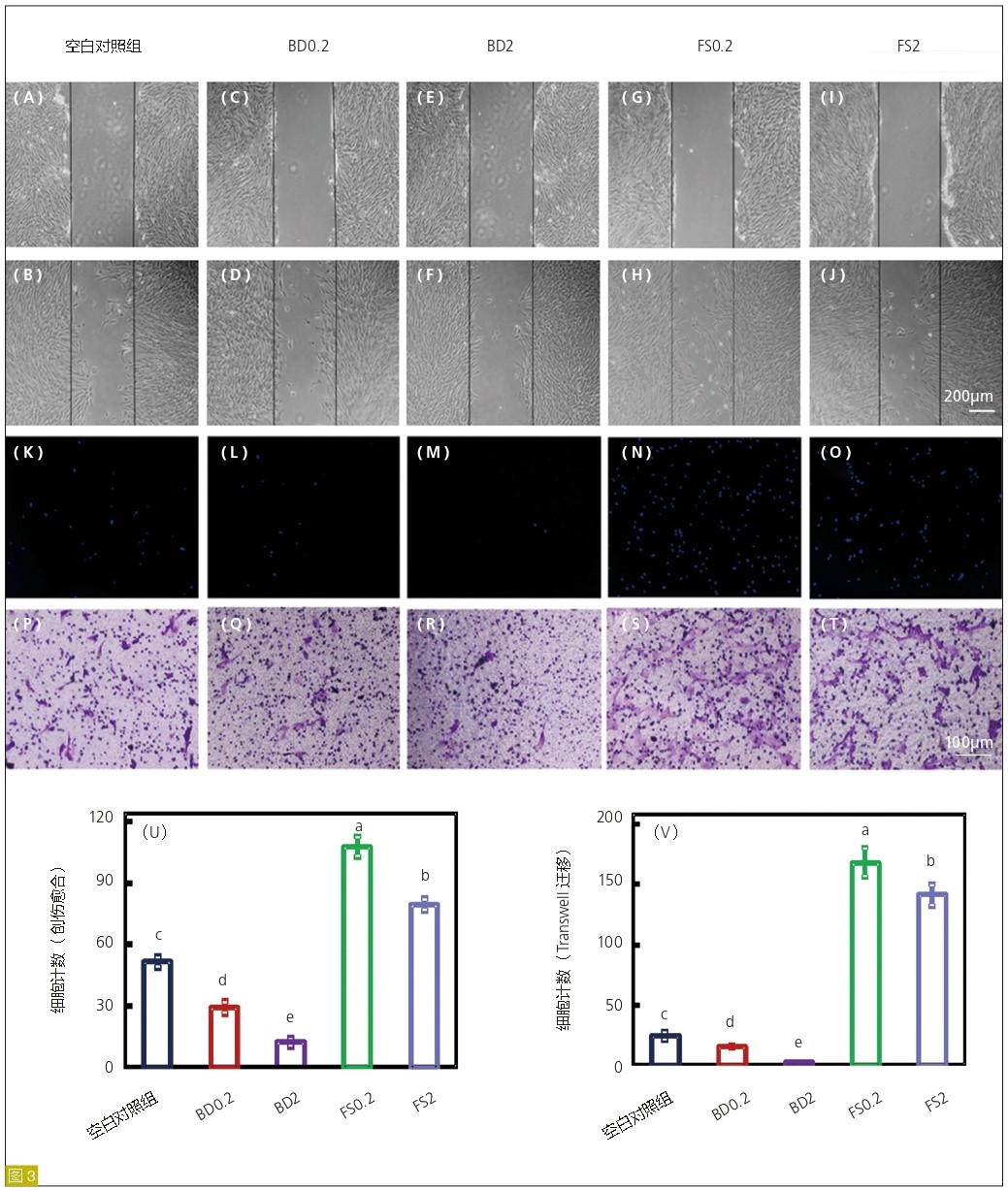
图3:采用创伤愈合(A-J)和Transwell(K-T)法检测空白对照组、BD、FS洗脱液组hDPSC的迁移。对于伤口愈合试验,分别在0(A,C,E,G和I)和24小时(B,D,F,H和J)时拍照并用于后续迁移细胞计数。对于Transwell分析,将hDPSCs添加到上方小室中并培养24小时,迁移细胞用DAPI(K-O)和结晶紫(P-T)染色。通过伤口愈合(U)和Transwell(V)实验量化细胞迁移率 (平均值±标准差;n=4)。不同字母代表的值之间差异显著(P<0.05)。
成骨分化
采用碱性磷酸酶(ALP)活性测定(图4)、ARS 染色( 图5) 和qRT-PCR检测成骨基因表达( 图6) 来评估hDPSC的分化程度。在第7天的时候,FS和BD组的ALP活性较空白对照组高。此外,与BD2组相比,BD0.2,FS0.2和FS2组碱性磷酸酶活性略有升高。在14天时,FS0.2组碱性磷酸酶活性明显高于其他组。此外,在21天测定矿化程度时,FS0.2组较空白对照组明显增强,但FS2、BD0.2和BD2组与空白对照组无差异。值得注意的是,FS0.2组COL1在第14天表达明显增多,而OCN在第7天表达明显增多。以上结果表明,FS0.2可以促进hDPSCs的成骨向分化。
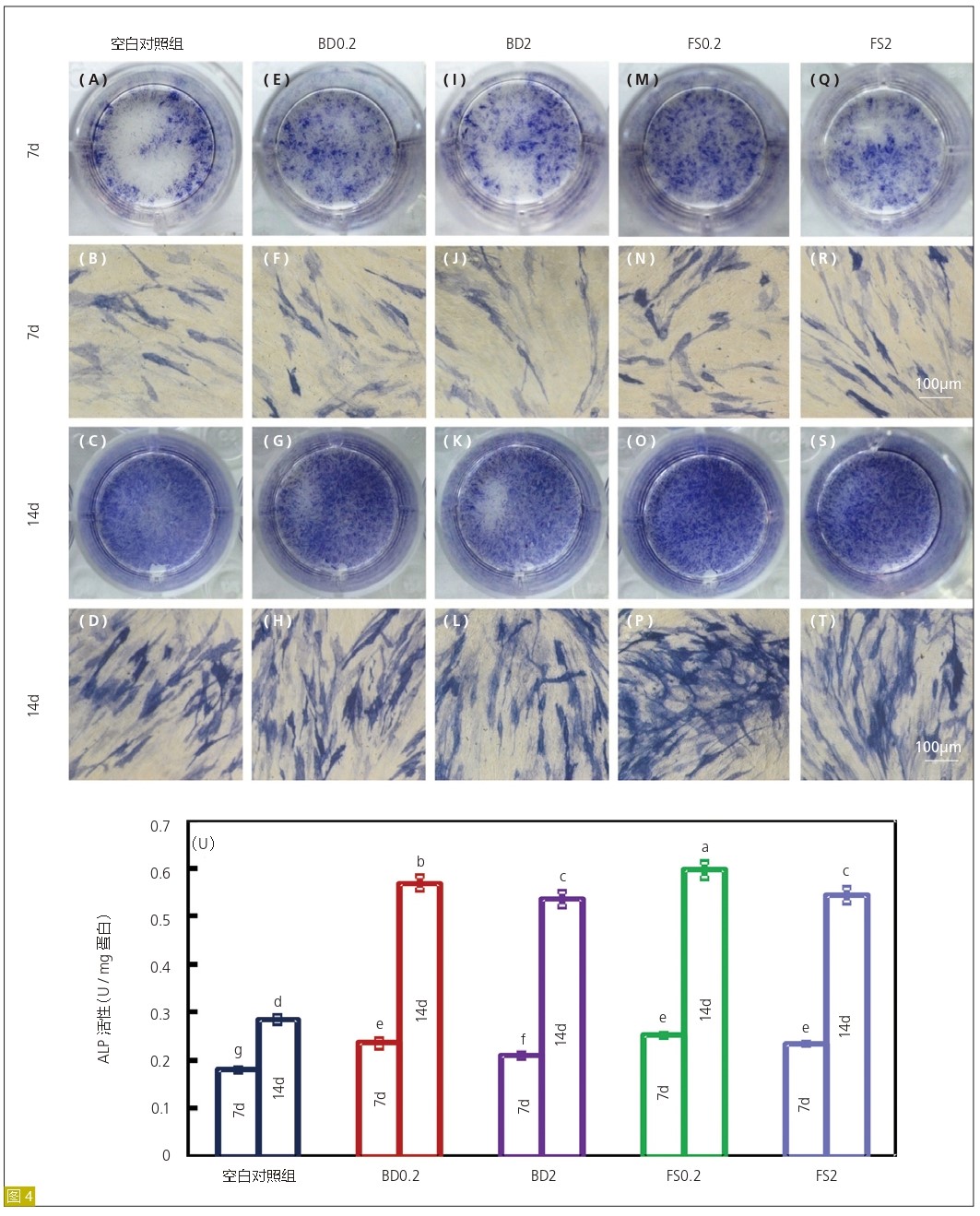
图4:iRoot FS对hDPSCs ALP活性的影响。第7天和第14天(A-T)对hDPSCs进行ALP染色。成骨诱导液中培养的细胞作为空白对照组。在成骨诱导液中添加BD的组作为阳性对照组。ALP活性定量分析(平均值±标准差;n=4)(U)。不同字母代表的数值间差异显著(P<0.05)。

图5:iRoot FS对矿物质合成的影响。对含或不含材料洗脱液的成骨诱导液中培养的hDPSCs进行茜素红染色(ARS)(A-J)。ARS染色定量分析(平均值±标准差;n=4)(H)。不同字母代表的数值间差异显著(P<0.05)。
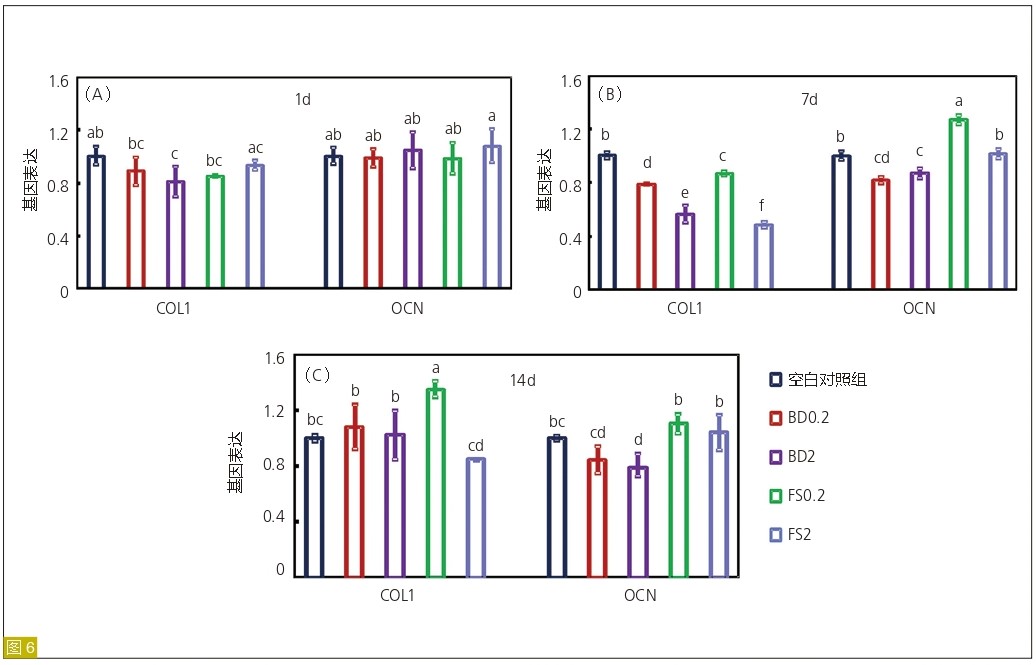
图6:iRoot FS对hDPSCs成骨相关基因表达的影响。第1、7、14天用qRT-PCR检测COL1和OCN的表达水平(A-C)。基因表达水平的定量分析(平均值±标准差;n=4)(U)。不同字母代表的数值间差异显著(P<0.05)。
讨论
hDPSCs是从牙髓组织中分离出来的一类具有干细胞特性的细胞,具有自我更新能力和多向分化潜能。hDPSCs在干细胞和再生疗法中起着关键的作用30-33。自从Gronthos在2000年先进次成功分离和培养hDPSCs后34,这些细胞便因其潜在的临床应用能力和易于获得而被广泛研究。在最近的一项研究中,研究者将hDPSCs移植到牙髓切除的牙齿中,结果表明hDPSCs可以安全有效地诱导牙髓再生35。有研究表明,hDPSCs在体外表达成骨和成血管基因,且可以在体内构建血管化编织骨。此外,Giuliani37发现将hDPSCs植入拔牙创会引起致密骨的形成。因此,hDPSCs预示着组织再生的新曙光。巧合的是,盖髓疗法其实也是hDPSC介导的再生过程。因此,hDPSCs是本研究的理想研究对象。
iRoot FS是一种最新被引入牙科领域的预混的、快速凝固的生物陶瓷糊剂。本研究是首项分析iRoot FS对hDPSCs的影响的研究,hDPSCs是一种直接或间接接触盖髓材料的细胞。hDPSCs的增殖、迁移和分化在盖髓治疗过程中是必不可少的。本研究的结果表明iRoot FS能促进hDPSCs的增殖、迁移和成骨向分化。因此,iRoot FS是一种具有良好生物相容性的盖髓材料。
值得注意的是,在盖髓过程中,并不是所有的细胞都可以直接接触到盖髓材料。因此,许多研究使用洗脱液来评估盖髓剂的生物学特性25,27,38,39。此外,材料洗脱液易于观察和定量分析。Hakki等人38制备了MTA洗脱液的浓度梯度以研究MTA对细胞增殖的影响,发现浓度低于20mg/mL的MTA洗脱液对细胞无明显毒性。Zhao等人25发现0.1-2mg/mL的MTA洗脱液可以明显增强细胞的活性。Luo等人27发现BD在0.2和2mg/mL浓度下,可以促进细胞增殖。基于先前报导的研究结果和前期数据,我们使用浓度2和0.2mg/mL进行实验。
在直接盖髓术中,医生将新鲜的预混材料放置在暴露的牙髓处直到材料凝固。理想的牙科修复材料应具有良好的生物相容性和促进细胞增殖的能力。然而,固化的材料可能会向周围组织释放有毒物质40。因此,评价盖髓材料对细胞活性的影响是评价材料生物相容性的重要指标。在本研究中,低浓度的FS和BD(FS0.2,BD0.2)在促进细胞增殖方面表现出明显的优越性。BD组的结果与Luo等人27的研究结果一致,可能是由于FS0.2或BD0.2中Ca²⁺的适当释放,从而线粒体基质脱氢酶41。然而,过多的Ca²⁺会抑制细胞增殖,甚至会导致细胞凋亡42。此外,Zhu等人43发现iRoot BP Plus和MTA的洗脱液中含有硅。以前的研究表明,高硅含量的生物陶瓷材料有利于细胞粘附和增殖。因此,FS在培养基中释放的大量硅离子有助于提高细胞的生物活性(图2)44,45。
创伤愈合过程主要分为三个阶段:炎症和纤维形成期、再生期和重塑期27。祖细胞增殖和迁移在牙本质修复中起着至关重要的作用。钙硅基材料表现出显著的修复能力。MTA可以促进hMSCs细胞的增殖、迁移和分化46。事实上,MTA盖髓的成功率高于氢氧化钙47。在大鼠牙髓损伤模型中48,分别使用ProRoot MTA、Biodentine或BioAggregate盖髓。micro-CT和免疫组化结果分析表明Biodentine或BioAggregate可以促进牙本质桥的形成,可作为ProRoot MTA的替代品。Shi等人49观察到iRoot BP Plus和MTA具有类似的盖髓效果。iRoot SP和iRoot FS也显示出良好的细胞相容性16,22。本研究首次报道了hDPSC 对盖髓材料iRoot FS的体外反应。
一个相当常见的迁移模式涉及肌动蛋白细胞骨架介导的细胞形态的变化50。材料可以通过物理和化学机制干预细胞的迁移。MTA可以促进细胞迁移46。在本研究中,FS组的hDPSCs迁移增多,这与Zhang等人51的研究结果一致。这些作者发现,iRoot BP Plus可以通过调节FGFR介导的信号通路促进细胞的迁移,FGFR信号通路可以上调局部粘附分子的表达,并参与应力纤维组装。以前的一项研究表明,低钙和高磷肌醇可以促进细胞膜的伸展。离子水平可能与BD2 组迁移细胞数量少有关52,53。
ALP是一种参与早期成骨分化和硬组织矿化的蛋白质。在矿化早期,ALP表达上调,产生无机磷酸盐用于羟基磷灰石的合成54。茜素红通过螯合钙盐形成一种橙红色的复合物,用于检测钙沉积。钙沉积代表晚期成骨分化55。钙硅基材料具有通过增加ALP表达和钙沉积从而促进成骨分化的潜能56。本研究结果表明,FS0.2显著促进了hDPSCs的矿化作用,而FS2,BD0.2和BD2没有这种效果,BD组在第7天和第14天ALP活性增加,但在第21天时,矿化却没有显著增加。这些结果与之前对BD 的研究结果并不完全一致28,其他研究表明,BD在14天时不仅能增加ALP活性,而且还能促进细胞矿化。这可能是因为这些研究中细胞所处的成骨分化阶段不同。本研究采用21天为一个周期,因为先前的研究显示,在诱导骨髓间充质干细胞成骨分化过程中,在第14-21天有明显的钙盐沉积29。COL1基因编码胶原蛋白,为无机盐的沉积提供框架,而OCN是矿化的主要非胶原标记物57。本研究结果表明,FS0.2首先促进OCN的表达,随后又上调COL1的表达。先前的证据证实了初期矿化可能不需要胶原的参与58。用逆转录聚合酶链反应(RT-PCR)和免疫荧光法检测牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP) 和牙本质基质蛋白1(dentin matrix protein 1,DMP1)等成牙本质细胞分化的特异性标记物的表达。然而,在大多数情况下都没有检测到DSPP和DMP1,或者在一些情况下表达非常不稳定。
结论
iRoot FS是一种能够促进hDPSCs增殖、迁移和成骨分化的快速凝固的生物材料。与生物牙本质相比,iRoot FS具有同样的促进细胞增殖能力,且在促进细胞迁移和矿化方面表现更佳。因此,本研究的结果表明iRoot FS是一个非常有前景的可用于盖髓的生物活性材料。
致谢
本研究得到了国家自然科学基金 No. 81201379 和81470722(JL)、国家优秀博士学位论文基金 No. 201365(JL)、四川大学优秀青年学者基金 No. 2014SCU04A10(JL)的支持。
稿源
本文摘自口腔专业杂志《PLOS ONE》2017;12(10):e0186848
doi.org /10.1371/ journal.pone.0186848
作者:
孙妍 1,罗涛 1,沈亚 2 Markus Haapasalo 2 邹凌 1,刘军 3
1 中国四川大学华西口腔医院牙体牙髓病科,口腔疾病国家重点实验室
2 加拿大不列颠哥伦比亚大学牙科学院口腔生物和医疗科学系牙髓病科
3 中国四川大学华西口腔医院正畸科,口腔疾病国家重点实验室
通讯作者:
刘军 junliu@scu.edu.cn
邹凌 zouling@scu.edu.cn
以上两位作者对本篇论文的贡献相同

暂无评论